Plan de l'article
Comment s'oxydent les alliages d'or et d'argent ?
Dans deux cas, les métaux précieux doivent être amenés à une température relativement élevée (entre 600 et 800 °C) pendant leur travail. D'abord lorsqu'ils ont été durcis par durcissement par traction et qu'il s'agit de leur redonner leur malléabilité, afin qu'ils puissent continuer à les déformer sans difficulté. Enfin, lors des opérations de brasage ou de soudage.

A lire également : Les indispensables accessoires à ne pas oublier pour profiter pleinement de votre festival de musique
Très souvent, ces opérations sont effectuées sans précaution particulière, dans l'air, et le métal est recouvert d'une couche d'oxyde. Dans le cas d'un alliage d'or, cet oxyde peut être éliminé par décapage dans une stalle acide (retrouvez nos produits de roche ici) et nous voyons alors que la couleur est parfois modifiée. L'or rose, par exemple, est devenu jaune. Avec l'argent de l'orfèvrerie 1er titre, on voit apparaître des taches sombres sur le métal, les taches de feu. Avec d'autres alliages d'argent, les phénomènes peuvent prendre d'autres aspects.
Qu'est-ce que le la nature profonde de ces phénomènes d'oxydation ? Comment les éviter ou corriger leurs effets ? Voici les questions auxquelles nous tenterons de répondre dans cet article !
A découvrir également : Comment s'habiller pour un mariage en décembre ?
Diffusion dans les solides
Tout d'abord, disons quelques mots sur le phénomène physique qui donne à l'oxydation les différents aspects qu'elle peut présenter, le phénomène dit de « diffusion ». La diffusion dans un solide est la propriété que les atomes qui composent ce solide possèdent pour se déplacer. Ceci est particulièrement bien observé dans le cas des alliages. Si certaines régions portent des titres différents, les atomes se déplacent des régions ayant la concentration la plus élevée vers des régions où leur concentration est plus faible.
Par exemple, si nous argentons par électrolyse un objet en or fin et que nous le chauffons, nous observons après peu de temps un changement radical d'aspect. Le métal argenté blanc est devenu vert. Un alliage or-argent s'est formé à la surface : des atomes d'argent ont pénétré l'or et ils ont été remplacés par des atomes d'or qui progressaient dans la direction opposée. Le même phénomène se serait produit si deux alliages différents avaient été plaqués l'un sur l'autre. La diffusion tend à homogénéiser les alliages.
Oxydation
L'oxydation d'un métal est la transformation de ce métal en oxyde, par réaction avec l'oxygène, le plus souvent celui de l'air. Si le cuivre est chauffé dans l'air, il se recouvre d'une couche d'abord rouge d'oxydule, puis noire d'oxyde. En revanche, l'or fin et l'argent ne changent pas de couleur. Ils ne réagissent pas avec l'oxygène présent dans l'air pour former un oxyde. Le cas de l'argent est cependant particulier, car il peut dissoudre l'oxygène, qui se diffuse progressivement de la surface exposée à l'air vers l'intérieur. Nous y reviendrons plus tard.
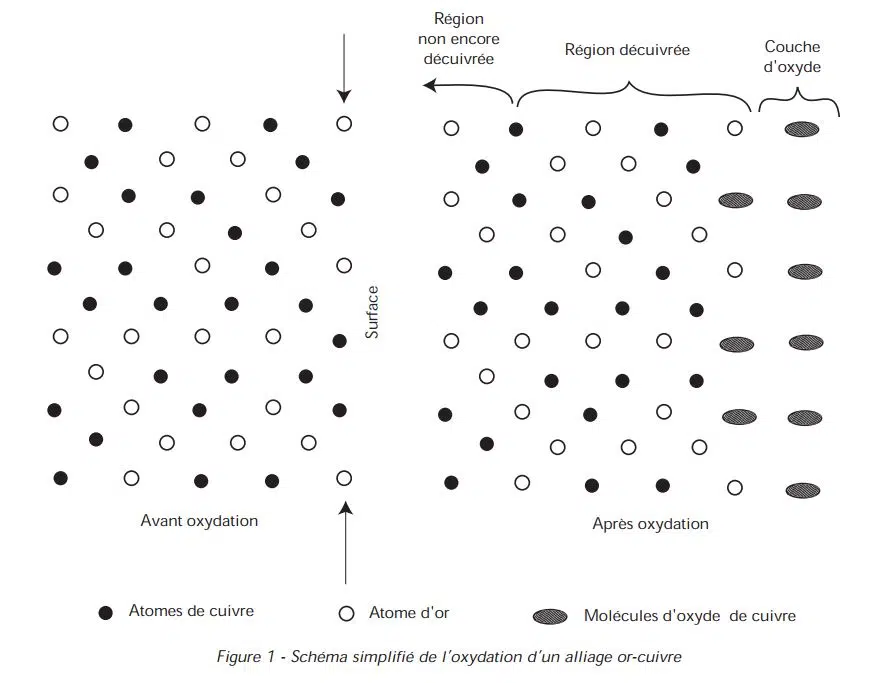
L'or n'est donc pas oxydable, tandis que le cuivre s'oxyde facilement. Lorsqu'un alliage d'or et de cuivre est chauffé à l'air, ce sont d'abord les atomes de cuivre à la surface, en contact direct avec l'oxygène de l'air, qui se transforment en oxyde. L'oxyde de cuivre n'est pas du cuivre. La surface de l'alliage présente donc une concentration nulle de cuivre, dès la première oxydation. Le phénomène de diffusion entre alors en jeu dans le métal, les atomes de cuivre se déplaçant de l'intérieur, où ils se trouvent à la concentration initiale, vers la surface où ils sont immédiatement consommés, pour former l'oxyde. Il y a un véritable « pompage » de cuivre de l'intérieur vers la surface, les atomes pompés les plus rapides étant les plus proches de la surface.
En bref, si nous arrêtons l'opération et effectuons une coupe de l'alliage Gold-Copper, nous pouvons observer :
- En surface, une couche d'oxyde,
- La surface elle-même est exempte de cuivre libre,
- Sous la surface, une concentration croissante de cuivre, jusqu'à la valeur initiale, qui se trouve à une certaine profondeur (trop éloignée de la surface pour avoir été affectée par la diffusion). Si le métal, dans cet état, est enlevé, c'est-à-dire si la couche d'oxyde est retirée, la surface présentera le aspect correspondant à sa composition, c'est-à-dire à l'aspect de l'or fin.
Avec alliage d'or, d'argent et de cuivre :
Avec un alliage or-argent-cuivre, un or rose 18 carats, par exemple, le phénomène est le même : le cuivre est éliminé en surface par la formation d'oxyde. Si vous décapez, l'apparence est celle d'un alliage de cuivre, c'est-à-dire jaune. En cas de polissage, la couche de surface appauvrie en cuivre est éliminée par abrasion et l'alliage initial est récupéré (Figure 1). Pour éviter le changement de teinte, il faut éviter de « sortir » le cuivre des couches superficielles par oxydation, il est donc nécessaire de fonctionner dans une atmosphère privée d'oxygène.
Dans l'industrie, des fours de recuit spécialement conçus sont utilisés, avec des atmosphères protectrices formées d'azote et d'hydrogène ou de dioxyde de carbone. En termes simples, les pièces peuvent être enfermées dans des boîtes en fer contenant des copeaux de fonte, qui fixent l'oxygène présent avant le cuivre. En soudage ou en brasage des opérations, des flux tels que le borax ou l'acide borique ou, mieux encore, des torches alimentées par des gaz chargés de composés gazeux d'acide borique peuvent être utilisés. Il forme sur la pièce, partout où il entre en contact avec la flamme, une fine couche protectrice d'acide borique fondu.
Avec l'argent :
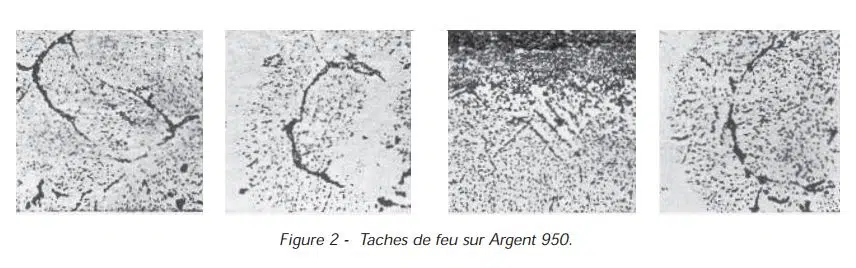
L'argent, nous l'avons dit, est un cas distinct puisqu'il peut dissoudre l'oxygène. Lorsque l'argent fin est chauffé à l'air, son aspect ne change pas mais en fait il est enrichi en oxygène, qui se déplace progressivement de la surface vers l'intérieur, par diffusion. Par conséquent, dans le cas des alliages d'argent chauffés à l'air, les alliages argent-cuivre, par exemple, deux diffusions, dans des directions opposées, sont possibles : diffusion du cuivre de la surface vers l'intérieur, diffusion de l'oxygène de la surface vers l'intérieur. Si la vitesse du cuivre est supérieure à celle de l'oxygène, une couche superficielle d'oxyde se forme. Si la vitesse de l'oxygène est plus élevée, il pénètre dans l'alliage où il oxyde le cuivre. C'est le phénomène d' « oxydation interne ». Si l'on observe au microscope une coupe de ce métal oxydé, on voit clairement les grains d'oxyde formés (fig. 2)
Extérieurement, l'argent a pris une teinte sombre, il s'est créé une « tache de feu » pour lui-même. La vitesse de diffusion du cuivre est d'autant plus grande que sa concentration est elle-même plus importante. C'est donc sur des alliages riches en cuivre, comme l'argent à 835 ‰, que l'on observe la formation de couches noires d'oxyde de cuivre. Par contre, des taches de feu, par oxydation interne, apparaissent sur des alliages plus dilués, comme l'argent premier titre.
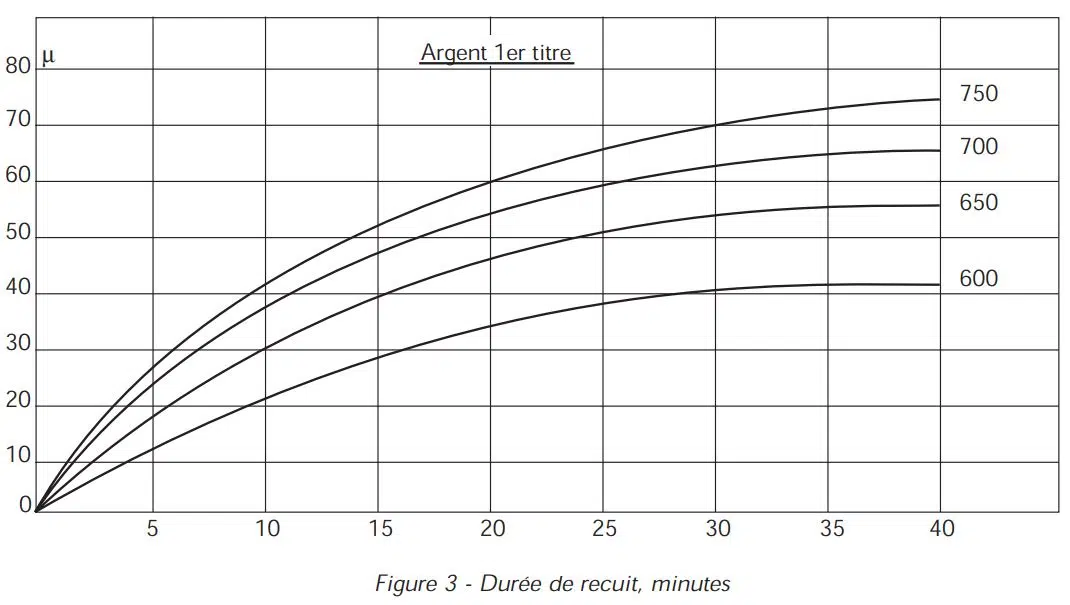
Nous avons recueilli les résultats de nos propres observations dans le laboratoire Cookson-CLAL, sous forme de courbes (Figure 3) qui donnent les profondeurs de pénétration de l'oxygène, donc les profondeurs des points de feu, en fonction du temps et de la température. Nous voyons, par exemple, que le chauffage de l'argent du 1er titre dans l'air, à 750°C pendant 10 minutes, provoque la formation d'une tache de 42 microns, soit 0,042 mm d'épaisseur.
Que faire contre les taches de feu provenant de l'argent ?
Contre les taches de feu d'argent 1er titre, il existe un remède et deux palliatifs :
- Le traitement consiste à éviter l'oxydation par l'utilisation d'une atmosphère ou d'une protection appropriée, et nous nous référons à ce qui a été dit plus haut, à propos des alliages d'or.
- Le premier palliatif consiste à masquer la tache de feu par un dépôt galvanique d'argent fin. (Retrouvez notre gamme pour la galvanoplastie).
- La seconde consiste à retirer le métal par polissage (retrouvez ici tous les équipements de polissage). Mais nous savons ce qu'une telle chirurgie est douloureuse pour l'orfèvre et mutilante pour l'objet !
Des taches de feu peuvent également se former dans les alliages d'argent qui s'oxydent en formant une couche d'oxyde. En effet, on observe le même phénomène que dans les alliages, l'or, c'est-à-dire une déplétion du métal par oxydation sous la surface. Par exemple, l'argent du deuxième titre est recouvert d'une oxydation avec une couche d'oxyde de cuivre, mais les régions sous-jacentes adjacentes au métal sont appauvries en cuivre, et il est donc possible que l'oxygène y pénètre et provoque le phénomène d'oxydation interne.
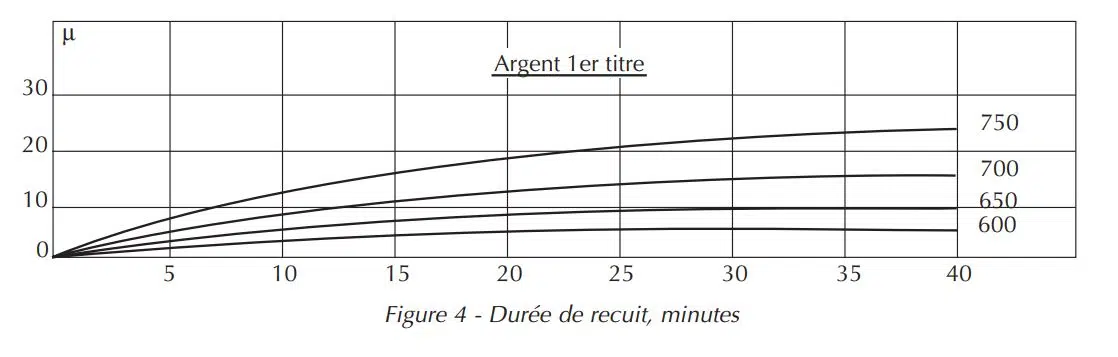
De plus, après le décapage, ce n'est pas la belle surface de l'alliage initial qui risque de se présenter, mais une surface terne. La figure 4 montre la profondeur de pénétration de l'oxygène dans le deuxième titre en argent recuit à l'air, en fonction de la température et du temps de recuit. On voit que la vitesse de croissance des points de feu dans cet alliage est encore inférieure à celle du 1er titre d'argent.
Laissez-nous mentionner ici un autre aspect du phénomène précédent. Soyons un deuxième alliage de titre qui a été oxydé et décapé. Il est donc recouvert d'une couche d'argent fin où les grains d'oxyde de cuivre sont occlus. Cette couche se comporte vis-à-vis de l'oxygène comme une couche d'argent fin où l'oxygène peut se diffuser très rapidement. Si ce métal décapé est recuit à nouveau, qu'une couche d'oxyde n'isole pas du contact direct avec l'oxygène dans l'air, il commence par diffusant très rapidement dans la couche superficielle jusqu'à ce qu'il atteigne l'alliage riche, situé juste en dessous, où l'oxygène ne peut pas se diffuser. Une couche d'oxygène est ensuite formée, prise en sandwich entre l'alliage avec peu ou pas de cuivre et la couche de surface non cuivrée. Le métal, apparemment, reste blanc, mais il en faut très peu pour que la couche d'argent fin se détache, se décolle et découvre la couche noire qu'elle masquait.
phénomènes d'oxydation peuvent donc prendre de nombreux aspects. Compte tenu de leur importance pratique, ils font l'objet d'études scientifiques approfondies et de nombreux articles y ont déjà été consacrés. Les
Nous ne les avons décrits ici que de façon simplifiée, afin de donner une image concrète de ce qui se passe dans des cas qui nous sont familiers, et pour aider les bijoutiers à résoudre leurs problèmes quotidiens. Contactez-nous pour plus d'informations techniques et métallurgiques !